trong 800ml dung dịch có chứa 8g NaOH
a, tính \(C_M\) của dung dịch NaOH
b, cần bao nhiêu ml \(H_2\)O vào dung dịch trên để thu dc dung dịch có nồng độ NaOH là 0,1 M
Trong 800ml của một dung dịch có chứa 8g NaOH.
a) Tính nồng độ mol của dung dịch này.
b) Phải thêm bao nhiêu ml nước vào 200ml dung dịch này để được dung dịch NaOH 0,1M?
a)
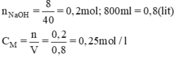
b) nNaOH có trong 200ml dung dịch NaOH 0,25M là

VH2O cần dùng để pha loãng 200ml dung dịch NaOH 0,25M để dung dịch NaOH 0,1M.
VH2O = 500 - 200 = 300ml H2O.
Trong 800 ml của một dung dịch có chứa 8 g NaOH.
a) Hãy tính nồng độ mol của dung dịch này.
b) Phải thêm bao nhiêu ml nước vào 200 ml dung dịch này để được dung dịch NaOH 0,1 M ?
a) Số mol của NaOH là:
n = 0,2 mol
Nồng độ mol của dung dịch là:
CM = = 0,25 M
b. Thể tích nước cần dùng:
- Số mol NaOH có trong 200 ml dung dịch NaOH 0,25 M:
nNaOH = = 0,05 mol
Thể tích dung dịch NaOH 0,1 M có chứa 0,05 NaOH
Vdd = = 500 ml
Vậy thể tích nước phải thêm là:
= 500 – 200 = 300 ml
a) Số mol của NaOH là:
n = 0,2 mol
Nồng độ mol của dung dịch là:
CM = = 0,25 M
b. Thể tích nước cần dùng:
- Số mol NaOH có trong 200 ml dung dịch NaOH 0,25 M:
nNaOH = = 0,05 mol
Thể tích dung dịch NaOH 0,1 M có chứa 0,05 NaOH
Vdd = = 500 ml
Vậy thể tích nước phải thêm là:
= 500 – 200 = 300 ml
Xem thêm tại: http://loigiaihay.com/bai-4-trang-151-sgk-hoa-hoc-8-c51a10352.html#ixzz49UQu5vYO
a) Số mol của NaOH là:
n = 0,2 mol
Nồng độ mol của dung dịch là:
CM = = 0,25 M
b. Thể tích nước cần dùng:
– Số mol NaOH có trong 200 ml dung dịch NaOH 0,25 M:
nNaOH = = 0,05 mol
Thể tích dung dịch NaOH 0,1 M có chứa 0,05 NaOH
Vdd = = 500 ml
Vậy thể tích nước phải thêm là:
VH2O = 500 – 200 = 300 ml
trong 400 ml của một dung dịch có chứa 8g NaOH.
a) tính nồng độ mol của dung dịch trên
b)cần thêm bao nhiêu ml nước vào 200 ml dung dịch trên để được dung dịch NaOH 0,2M
a) nNaOH = 8/40= 0,2 (mol)
CMNaOH= 0,2/0,4=0,5 (M)
Câu 2: Trộn 200 ml dung dịch HCl 1M với 300 ml dung dịch HCl 1,5 M thu được dung dịch HCl có nồng độ mol/lit là bao nhiêu?
Câu 3: Cần thêm bao nhiêu ml H2O (D = 1 g/ml) vào 100 gam dung dịch NaOH 35% để thu được dung dịch NaOH 20%.
Câu 4: Cần pha bao nhiêu lít dung dịch HCl 2M với bao nhiêu lít dung dịch HCl 3M để thu được 4 lít dung dịch HCl 2,75M.
Câu 2 :
$n_{HCl} = 0,2.1 + 0,3.1,5 = 0,65(mol)$
$V_{dd} = 0,2 + 0,3 = 0,5(mol)$
$C_{M_{HCl}} = \dfrac{0,65}{0,5} =1,3M$
Câu 3 :
Gọi $m_{H_2O\ cần\ thêm} =a (gam)$
Sau khi thêm :
$m_{NaOH} = 100.35\% = 35(gam)$
$m_{dd} = 100 + a(gam)$
Suy ra: $\dfrac{35}{100 + a}.100\% = 20\%$
Suy ra: a = 75(gam)
Câu 4 :
Gọi $V_{dd\ HCl\ 2M} =a (lít) ; V_{dd\ HCl\ 3M} = b(lít)$
Ta có :
$a + b = 4$
$2a + 3b = 4.2,75$
Suy ra a = 1(lít) ; b = 3(lít)
Trong 800ml dd NaOH có 8g NaOH.
a/ Tính nồng độ mol của dung dịch NaOH ?
b/ phải thêm bao nhiêu ml nước vào 200ml dung dịch NaOH để có dung dịch NaOH 0,1M?![]() Help với ạ
Help với ạ
a) \(n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
\(C_{M_{NaOH}}=\dfrac{0,2}{0,8}=0,25M\)
b) \(n_{NaOH}=0,2.0,25=0,05\left(mol\right)\)
\(V_{dd}=\dfrac{0,05}{0,1}=0,5\left(l\right)=500\left(ml\right)\)
=> VH2O = 500 - 200 = 300 (ml)
Hoà tan 8g NaOH vào nước để được 800ml dung dịch Nồng độ mol của dung dịch thu được là:
A: 0,22M B:0,23M C: 0,24M D: 0,25M
Trong 800 ml của một dung dịch có chứa 8g NaOH
a) hãy tính nồng độ mol của dung dịch này
b) Phải pha thêm bao nhiêu ml nước vào 200 ml dung dịch này để được dung dịch NaOH 0,1M
a) Ta có: 800ml=0,8 lít
nNaOH=m/M=8/40=0,2 (mol)
=> CM=\(\dfrac{n}{V}=\dfrac{0,2}{0,8}=0,25\left(M\right)\)
b) Ta có: 200ml=0,2 lít
=> nNaOH=CM.V=0,1.0,5=0,05 (mol)
Gọi x là sô gam nước cần thêm vào:
=> \(0,1=\dfrac{0,05}{x}\)
=> x=0,5 lít =500ml
Vậy cần phải thêm vào 500 - 200 =300 ml nước
a)đổi 700ml=0,8 lít
nNaOH=8/40=0,2mol
CM=n/V=0,2/0,8=0,25M
b) đổi 200ml=0,2 lít
nNaOH=0,25.0,2=0,05mol
gọi x là số gam nước cần thêm vào
=> \(0,1=\dfrac{0,05}{x}=>x=0,5\) ( lít )=500ml
Vậy cần thêm vào 500-200=300ml nước
Cho 100 ml dung dịch H2 SO4 2m vào 100 ml dung dịch BaCl2 1M thu được dung dịch A và kết tủa B a) Tính khối lượng kết tủa B thu được b) Tính nồng độ mol các chất có trong dung dịch A c) để trung hòa dung dịch A thì cần bao nhiêu gam dung dịch NaOH 15%
a)
$BaCl_2 + H_2SO_4 \to BaSO_4 + 2HCl$
$n_{BaCl_2} = 0,1 < n_{H_2SO_4} = 0,2$ nên $H_2SO_4$ dư
$n_{BaSO_4} = n_{BaCl_2} = 0,1(mol)$
$m_{BaSO_4} = 0,1.233 = 23,3(gam)$
b)
A gồm :
$HCl : 0,1.2 = 0,2(mol)$
$H_2SO_4\ dư : 0,2 - 0,1 = 0,1(mol)$
$V_{dd} = 0,1 + 0,1= 0,2(lít)$
$C_{M_{HCl}} = \dfrac{0,2}{0,2} = 1M$
$C_{M_{H_2SO_4}} = \dfrac{0,1}{0,2} = 0,5M$
c)
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
$n_{NaOH} = 2n_{H_2SO_4\ dư} = 0,2(mol)$
$m_{dd\ NaOH} = \dfrac{0,2.40}{15\%} = 53,33(gam)$
Trong 800 ml của một dung dịch chứa 8 g NaOH. a,hãy tính nồng độ mol của dung dịch này. b, phải thêm bao nhiêu ml nước vào 200ml dung dịch này để được dung dịch NaOH 0,1 m